Deep generative AI models analyzing circulating orphan non-coding RNAs enable detection of early-stage lung cancer
폐암의 치명성과 조기진단의 필요성
폐암은 미국의 암 사망 원인 중 가장 높은 비중을 차지한다. 매년 대장암, 유방암, 전립선암으로 인한 사망을 모두 합한 것보다 더 많은 사망자가 발생하고 있다. 더욱 심각한 것은 전체 폐암 사례 중 단 23%만이 전이가 일어나기 전(1-3기)에 발견된다는 점이다. 조기에 발견될 경우 5년 생존율이 59%에 달하지만, 현재의 검진 방법으로는 이런 조기 발견이 쉽지 않은 실정이다.
기존 액체생검의 한계
현재까지의 액체생검 기술은 여러 한계를 보여왔다. 순환종양 DNA 기반의 종양 맞춤형(tumor-informed) 액체생검 검사는 초기 암 진단에서 55-57%의 낮은 민감도를 보였다. DNA 메틸화나 DNA 분절 패턴을 활용한 에피지놈 검사들이 개발되었으나, DNA 방출이 제한적인 초기 암이나 작은 크기의 종양에서는 여전히 민감도가 낮았다.
최근의 에피지놈 연구들은 폐암 검출에서 더 높은 민감도를 보고했지만, 이는 낮은 특이도를 대가로 한 것이었다. 예를 들어 마존 등의 연구는 84%의 민감도(95% 신뢰구간: 79-88%)와 53%의 특이도(95% 신뢰구간: 45-61%)를 보고했다. 홍 등의 연구에서는 1기 폐암에서 58%의 민감도(95% 신뢰구간: 49-67%)와 75%의 특이도(95% 신뢰구간: 71-79%)를, 2기 폐암에서는 74%의 민감도(95% 신뢰구간: 63-83%)와 30%의 특이도(95% 신뢰구간: 24-37%)를 보였다.
혁신적인 바이오마커 oncRNA의 발견
엑사이바이오와 아크연구소 연구진은 암세포의 크로마틴 재구성으로 인해 특이적으로 발현되는 새로운 유형의 RNA를 발견했다. 이들은 이를 ‘oncRNA’로 명명했다. 연구진은 TCGA(The Cancer Genome Atlas) 데이터베이스의 smRNA-seq 데이터를 분석해 255,393개의 폐암 특이적 oncRNA를 포함한 총 777,291개의 oncRNA 카탈로그를 구축했다. oncRNA는 기존의 종양 DNA와 달리 살아있는 암세포에서 능동적으로 발현되고 분비되는 특징이 있어, 세포 사멸이 일어나지 않아도 혈액 검사로 검출이 가능하다..
생성형 AI 모델 ‘오리온’의 개발과 구조
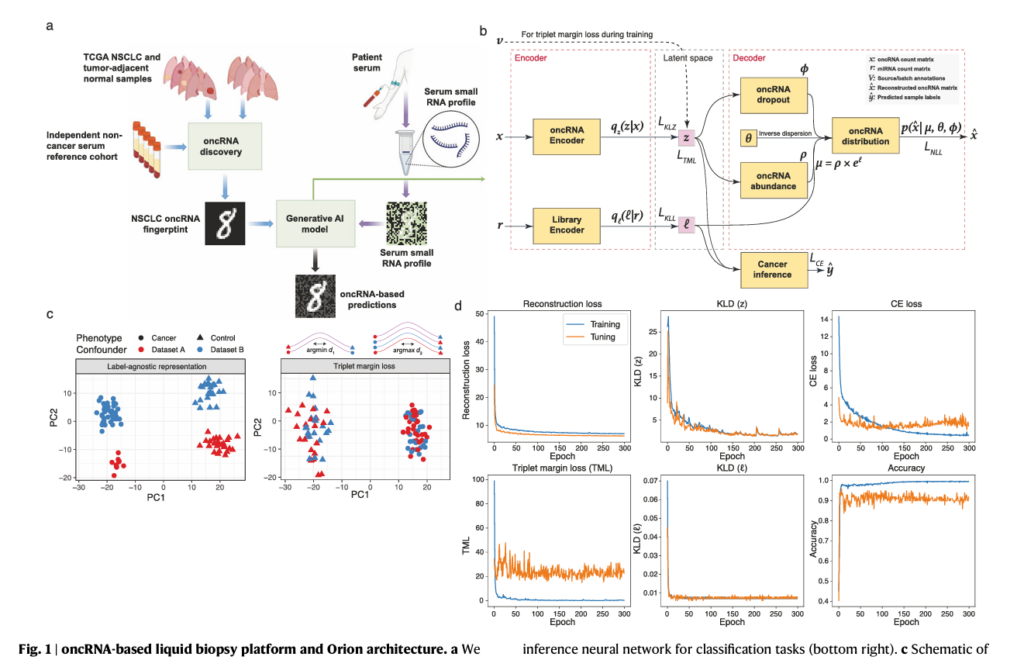
연구진은 oncRNA를 효과적으로 분석하기 위해 두 개의 입력단을 가진 반지도 학습 기반의 다중 입력 변분 오토인코더 ‘오리온’을 개발했다. 첫 번째 입력단은 oncRNA 데이터를 처리하고, 두 번째 입력단은 발현된 주석된 smRNA를 처리하여 시퀀싱 라이브러리의 크기 차이를 보정한다.
오리온은 제로팽창 음이항 분포를 사용해 혈액 기반 측정의 희박성(sparsity)과 과분산(over-dispersion) 특성을 반영했다. 또한 트리플렛 마진 로스를 도입해 샘플 출처나 실험 배치와 같은 기술적 변이를 효과적으로 제거했다.
엄격한 샘플 선정과 실험실 프로토콜
연구팀은 치료 이력이 없는 폐암 환자 419명과 대조군 631명의 혈액 샘플을 분석했다. 18세 이하, 이전 암 진단 이력, 최근 1개월 내 수술 이력, 면역 조절 치료 이력, 장기 이식 이력, 최근 혈액 제제 투여 이력, 현재 코로드19 감염, 임신 이력이 있는 경우는 제외됐다.
각 혈청 샘플에서 RNA를 추출하고 SMARTer smRNA-Seq 키트를 사용해 라이브러리를 제작했다. NextSeq 2000 기기로 평균 19.8 ± 5.8백만 리드의 시퀀싱을 수행했다.
엄격한 검증을 통한 모델의 성능 평가
전체 데이터의 80%를 훈련에, 20%를 독립적인 검증에 활용했다. 10-폴드 교차검증을 실시했으며, 각 폴드마다 5개의 서로 다른 랜덤 시드로 모델을 훈련시켜 결과의 신뢰성을 높였다. 각 훈련 폴드에서는 공급업체별로 최소 2% 이상의 샘플에서 발견되고 암 환자에서 과발현된 oncRNA를 선별했으며, 평균 6,376(±60)개의 oncRNA가 선정됐다.
검증 결과 오리온은 ROC 곡선 하 면적 0.97(95% 신뢰구간: 0.96-0.98)을 기록했으며, 90% 특이도에서 94%의 민감도(95% 신뢰구간: 91-96%)를 달성했다. 특히 1기 폐암에서 90%의 민감도(95% 신뢰구간: 83-94%)를 보였고, 2cm 미만 종양에서도 87%의 민감도(95% 신뢰구간: 74-94%)를 기록했다. 이는 동일한 데이터에서 지지벡터기계(SVM)가 보인 61%의 민감도나 다른 기계학습 방법들의 성능을 크게 상회하는 결과다.
견고성과 일반화 가능성 검증
연구진은 다양한 방법으로 모델의 견고성을 검증했다. 시퀀싱 깊이에 따른 영향을 평가하기 위해 400만에서 6,000만 리드까지 다양한 깊이로 시퀀싱한 결과, 모델 점수와 시퀀싱 깊이 간의 상관관계는 미미했다(선형 모델 조정 R² = 0.154, 95% 신뢰구간: 0.004-0.546).
희석 실험에서는 암 환자의 혈액 샘플을 정상인의 혈액 샘플과 다양한 비율로 혼합했다. 오리온은 최대 40%까지 희석된 상태에서도 민감도 저하 없이 암을 검출할 수 있었다. 이는 다른 방법들에서는 관찰되지 않은 특징이다.
암 아형 구분 능력
오리온은 폐암의 주요 아형인 선암과 편평세포암을 구분하는 데도 성공했다. 3-4기 진행성 폐암에서 ROC 곡선 하 면적 0.75(95% 신뢰구간: 0.67-0.83)를 기록했으며, 70% 특이도에서 71%의 민감도(95% 신뢰구간: 56-84%)를 보였다. 이는 병리학자들의 폐암 아형 구분 일치도가 약 81%임을 고려할 때 주목할 만한 성과다.
기술적 차별성과 혁신
오리온의 주요 혁신은 생성적 샘플링을 통한 분류기 훈련과 트리플렛 마진 로스의 도입이다. 이를 통해 샘플 출처나 흡연 이력 같은 교란 변수의 영향을 최소화했다. 실제로 대조군 내에서 샘플 출처에 따른 ROC 곡선 하 면적이 0.53(95% 신뢰구간: 0.47-0.58)에 불과해, 기술적 변이가 효과적으로 제거됐음을 확인했다.
연구의 의의와 향후 전망
하니 구다르지 연구책임자는 “이번 연구는 생성형 AI와 새로운 바이오마커의 결합이 암 진단의 패러다임을 바꿀 수 있음을 보여준다”고 평가했다. 특히 액체 조직검사(liquid histology)를 통한 종양 아형 전이 모니터링이 가능해져, 표적 치료제 내성 발현 시 새롭게 출현하는 종양 개체군에 대한 맞춤형 치료가 가능해질 것으로 전망했다.
기사에 인용된 논문의 원문은 네이처에서 확인할 수 있다.
기사는 클로드 3.5 Sonnet과 챗GPT-4o를 활용해 작성되었습니다.
관련 콘텐츠 더보기